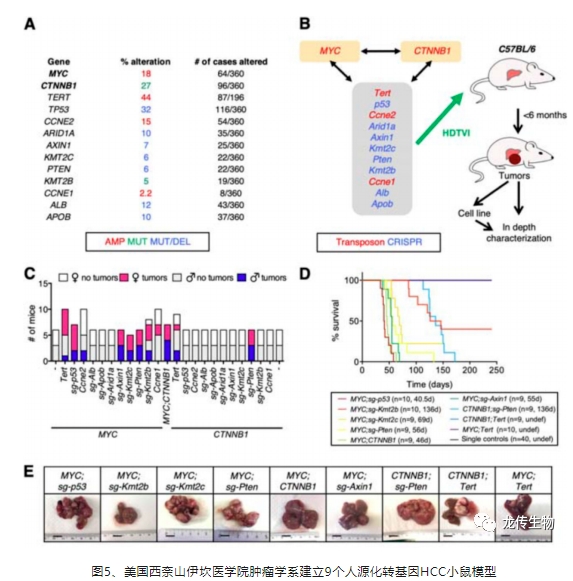
原发性肝癌(primary liver cancer,PLC)又称原位肝癌,是全球癌症相关的第三死因,其发病率呈上升趋势,预估到2025年罹患肝癌的病患,在全球范围内每年将成长大于一百万人。肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌形式,约占病例90%,它是一种预后较差的恶性肿瘤之一,在东亚地区发病率最高,72%的病例发生在亚洲,其中大于50%发生在中国[1]。
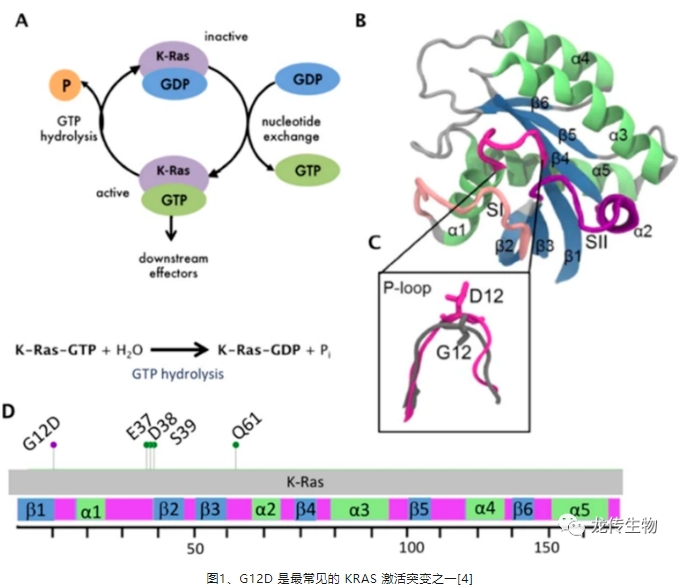
G12D 是最常见的 KRAS 激活突变(图1),不仅仅是原发性肝癌,KRAS G12D是腺癌类别中最常见的突变基因之一[3-4],随着KRAS G12D抑制剂进入临床试验,为了了解KRAS G12D癌症的生物学,确定免疫微环境如何影响治疗反应,一个有效评价的动物模型至关重要。然而针对KRAS G12D抑制剂的动物模型开发,大多为胰腺癌动物模型,且仅是皮下而非原位胰腺癌模型[5],目前仍比较缺乏人源化KRAS G12D原位肝癌动物模型,然而原位肝癌模型较皮下肿瘤模型更趋于HCC临床病患的肿瘤微环境[6]。
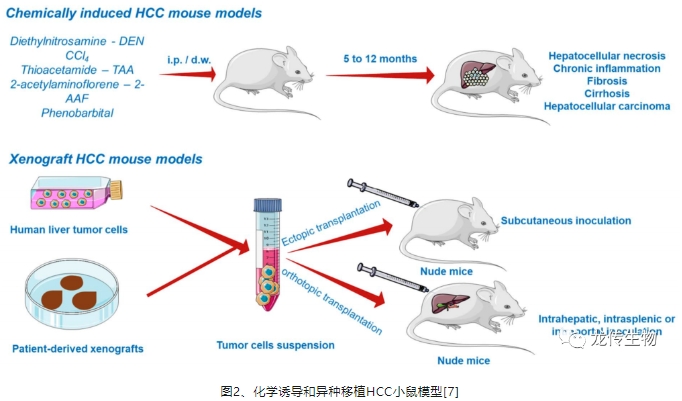
现有的原位肝癌小鼠模型通过化学诱导,如二乙基亚硝胺(DEN)等诱导成瘤的时间长达5个月至一年[7],而且还不是人源的仅是鼠源的原位肝癌模型(图2),无法呈现人类肿瘤微环境。通过肝细胞特异性Alb-Cre;KrasG12D转基因小鼠品系,自发的HCC成瘤时间约10个月,成模率46.2%[8],若再导入HBV X蛋白(HBx),可提早至8个月成瘤,成模率62.5%。
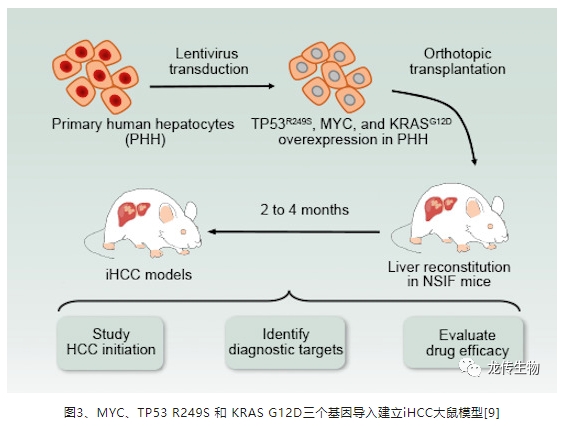
现有的KRAS G12D基因敲入小鼠的底层小鼠模型使用的是免疫健全鼠如C57BL/6(简称B6)等,免疫健全鼠对于异源细胞产生很强的免疫排斥,使用细胞液进行原位肝癌模型的造模成模率极低,一般都需要在免疫缺陷小鼠如裸小鼠上进行二次造模。目前市面上推广的B6-KrasLSL-G12D是个将KRAS G12D基因+终止密码序列LoxP-Stop-LoxP稳转到免疫健全小鼠基因组的模型,通过与带有肝脏组织特异性启动子且性成熟的B6-Alb Cre小鼠配繁、离乳、取组织提取基因组DNA、基因型鉴定、经过约数个月获得肝脏特异性表达KRAS G12D基因敲入小鼠,且在该小鼠约9月龄时才有明确成瘤,且该自发性肝癌肿瘤仍为鼠源而非人源,优点是自发性肝癌肿瘤模型更趋近于自然现象[10]。综上,目前市场上仍比较缺乏导入人源化KRAS G12D基因的原位肝癌模型。
四、人源化基因导入HCC小鼠模型的简介
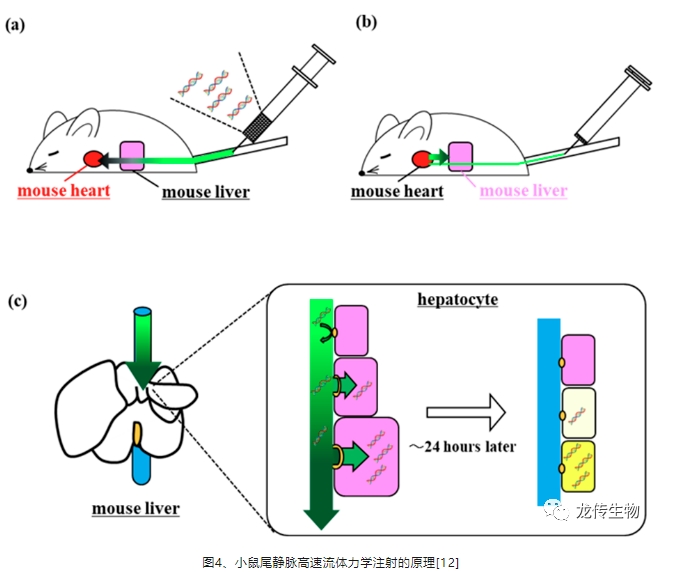
利用小鼠尾静脉高速流体力学注射(hydrodynamic injection、hydrodynamic tail vein injection或hydrodynamic gene delivery),简称HDI [11-12],通过快速将大量液体注入小鼠血管中产生的动态压力的物理力,将表达人源化基因的裸质粒DNA(naked plasmid DNA),由于注射引起的巨大水动力,肝孔扩大,使裸质粒进入肝细胞。一旦传递的裸质粒进入肝细胞,水动力压力减弱,肝孔闭合,裸质粒被留在肝细胞内(图4)。
故此,为克服现有动物模型的缺乏,龙传生物建立人源化KRAS G12D原位肝癌动物模型。首先,将处于对数生长期的人肝母细胞瘤细胞,以0. 25% 胰酶消化,收集消化液,离心后去除上清液,PBS 液洗2次后制成细胞悬液;使用SPF级无胸腺Balb/c-Nu小鼠进行细胞液肝脏原位接种。其次,以人KRAS基因(Genebank ID:NM_001369787.1)为参考序列,设计第12个氨基酸自甘氨酸(Glycine,Gly,G)突变为天冬氨酸(Aspartic acid,Asp,D),相应核苷酸序列GGT定点突变为GAT,构筑质粒为pLC-KRAS G12D。最后,于4周时通过HDI分别导入肝脏细胞低剂量和高剂量的pLC-KRAS G12D裸质粒,建立人源化KRAS G12D转基因原位肝癌小鼠模型,二次造模流程如图6。


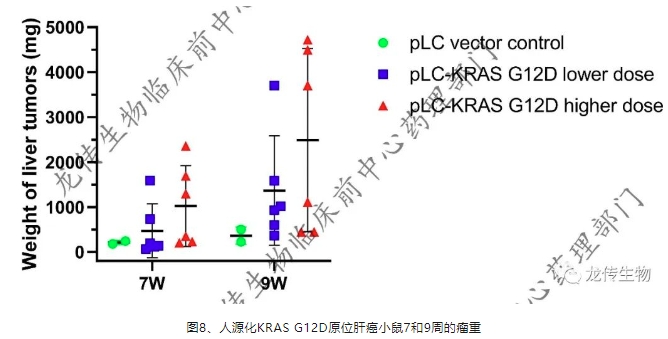
此种结合人源化原位肝癌小鼠和KRAS G12D裸质粒HDI转基因的复杂模型,自造模起计算7周即可快速达到100%成瘤,人源化原位肝癌小鼠保留了原有的肝癌组织结构特点,有和临床病患HCC肿瘤更为相近的生长环境和生物学特点,能够很好的模拟肝癌细胞的免疫逃逸和侵袭转移能力等肿瘤微环境,适用于靶向KRAS G12D肝癌精准治疗的PROTAC靶向蛋白降解剂、小分子药物、小核酸siRNA药物和基因治疗领域等新药研发的复杂模型,能实现各种人类致癌基因引起肝癌人源化小鼠的高效和经济建模。利用此技术方案,可以有效的构建过程简单、经济、有效、快速成模的人源化KRAS G12D基因过表达的原位肝癌小鼠模型,更佳地模拟人类肝细胞癌病患的肿瘤微环境,且填补人源化KRAS G12D基因和原位肝癌动物复杂模型的空白,利用此动物模型的临床前药效评价,更能真实的反应在人类病患的临床试验。进一步以此模型为基础,能开发人类肝细胞癌相关突变致癌基因各种的人源化致癌基因原位肝癌动物复杂模型的建模。
参考文献
[1] Llovet JM, Kelley RK, Villanueva A, Singal AG, Pikarsky E, Roayaie S, Lencioni R, Koike K, Zucman-Rossi J, Finn RS. Hepatocellular carcinoma. Nat Rev Dis Primers. 2021 Jan 21;7(1):6.
[2] D'Artista L, Moschopoulou AA, Barozzi I, Craig AJ, Seehawer M, Herrmann L, Minnich M, Kang TW, Rist E, Henning M, Klotz S, Heinzmann F, Harbig J, Sipos B, Longerich T, Eilers M, Dauch D, Zuber J, Wang XW, Zender L. MYC determines lineage commitment in KRAS-driven primary liver cancer development. J Hepatol. 2023 Jul;79(1):141-149.
[3] Zeissig MN, Ashwood LM, Kondrashova O, Sutherland KD. Next batter up! Targeting cancers with KRAS-G12D mutations. Trends Cancer. 2023 Aug 15. pii: S2405-8033(23)00137-1.
[4] Vatansever S, Erman B, Gümüş ZH. Oncogenic G12D mutation alters local conformations and dynamics of K-Ras. Sci Rep. 2019 Aug 13;9(1):11730.
[5] Kemp SB, Cheng N, Markosyan N, Sor R, Kim IK, Hallin J, Shoush J, Quinones L, Brown NV, Bassett JB, Joshi N, Yuan S, Smith M, Vostrejs WP, Perez-Vale KZ, Kahn B, Mo F, Donahue TR, Radu CG, Clendenin C, Christensen JG, Vonderheide RH, Stanger BZ. Efficacy of a Small-Molecule Inhibitor of KrasG12D in Immunocompetent Models of Pancreatic Cancer. Cancer Discov. 2023 Feb 6;13(2):298-311.
[6] Qiu R, Murata S, Cheng C, Mori A, Nie Y, Mikami S, Hasegawa S, Tadokoro T, Okamoto S, Taniguchi H. A Novel Orthotopic Liver Cancer Model for Creating a Human-like Tumor Microenvironment. Cancers (Basel). 2021 Aug 8;13(16) pii: cancers13163997.
[7] Blidisel A, Marcovici I, Coricovac D, Hut F, Dehelean CA, Cretu OM. Experimental Models of Hepatocellular Carcinoma-A Preclinical Perspective. Cancers (Basel). 2021 Jul 21;13(15) pii: cancers13153651.
[8] Ye H, Zhang C, Wang BJ, Tan XH, Zhang WP, Teng Y, Yang X. Synergistic function of Kras mutation and HBx in initiation and progression of hepatocellular carcinoma in mice. Oncogene. 2014 Oct 23;33(43):5133-8.
[9] Jiang Z, Cheng L, Wu Z, Zhou L, Wang H, Hong Q, Wu Q, Long Y, Huang Y, Xu G, Yao Y, Tang Z, Zhang Z, Yang L, Luo W, Yang J, Gong L, Liu P, Chen X, Cui S, Zhang Q, Li Y, Li P. Transforming primary human hepatocytes into hepatocellular carcinoma with genetically defined factors. EMBO Rep. 2022 Jun 7;23(6):e54275.
[10] Kras-G12D mice(Strain NO.T007054)on the GemPharmatech (Nanjing, China) Website. https://www.gempharmatech.com/shop/detail/11322.html
[11] Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 1999 Jul;6(7):1258-66.
[12] Shingo N, Naoko A, Masayuki I, Masahiro S. In vivo Hepatocyte Genome Manipulation via Intravenous Injection of Genome Editing Components. OBM Genetics. 2020 Nov 16;4(4). doi:10.21926/obm.genet.2004119.
[13] Molina-Sánchez P, Ruiz de Galarreta M, Yao MA, Lindblad KE, Bresnahan E, Bitterman E, Martin TC, Rubenstein T, Nie K, Golas J, Choudhary S, Bárcena-Varela M, Elmas A, Miguela V, Ding Y, Kan Z, Grinspan LT, Huang KL, Parsons RE, Shields DJ, Rollins RA, Lujambio A. Cooperation Between Distinct Cancer Driver Genes Underlies Intertumor Heterogeneity in Hepatocellular Carcinoma. Gastroenterology. 2020 Dec;159(6):2203-2220.e14.


